医療機器製造販売業の許可、医療機器製造業の登録の取り方の説明になります。
(医療機器製造販売業は許可ですが、医療機器製造業は登録と言います)
ここでは、許可や登録のための前準備として、
★人的要件の確認
★必要となる業務システムの作成
(医療機器の品質マニュアル(品質管理監督システム基準書、QMS手順書)
医療機器GVP手順書)
★構造設備要件の確認
を説明します。
ここで、
これらの前準備が出来ましたら、次のステップとしての、医療機器製造販売業と医療機器製造業の許可申請~取得 に進みます。
20. 医療機器輸入して販売しようとお考えの時(前準備)
ここに書いてある、前準備が出来ない、人が揃わない、前準備の事でわからない==>お問い合わせから、質問してください。
20.1 医療機器製造販売業許可の種類(前準備)
医療機器製造販売業の許可はその扱う製品のクラス分類により、下記のように3っの種類があります。
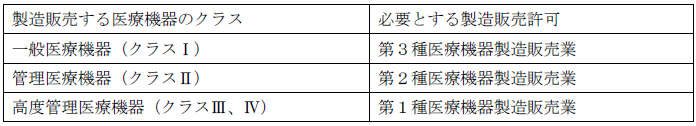
*医療機器のクラス分類については、 1.2.1 その商品(製品)は、どの医療機器に該当しますか? を読んで下さい。
医療機器製造販売業の許可は重複して持つ必要はありません。
(第1種医療機器製造販売業を持っていれば、下位の第2種、第3種もあつかえます)
(第2種医療機器製造販売業を持っていれば、下位の第3種もあつかえます)
クラス1,2,3,4と第1種、2種、3種が逆の番号の付け方ですので、混乱しますね
20.2 医療機器製造販売業 の許可の取り方(前準備)
医療機器製造販売業者には、法人でも個人(個人事業主)でもなることが出来ますので、ここでの申請者って書くのは両方指しています。
*下記に書きますが、人的要件、システム要件だけですので、設備的なものは不要なのです。極論言えば、医療機器製造販売業は机1つでも許可はOKなのです。
医療機器製造販売業の許可の申請者の要件
会社定款の目的に医療機器の輸入販売 ってのが必要になります。
ざっくり書きますが、申請者の欠格事項ってのがいくつかあります。代表者や役員に、薬機法(旧薬事法)の許可取り消しや禁固以上の刑、薬事に関する違反の経歴、後見開始の審判 などが居る場合は申請することが出来ません。また、麻薬、大麻などの中毒者でないことも、医師の診断書で証明しなければなりません。*R3年8月から医師の診断書は原則不要になりました。
医療機器製造販売業の許可には、人的要件 と 業務システム要件(システムって言ってもコンヒューターとかITとかではありません)が必要になります。
医療機器製造販売業の人的要件

総括製造販売責任者、国内品質業務運営責任者、安全管理責任者を常勤で配置する。
(医療機器製造販売業の種類により、この3名の兼務ができます)
東京都のPDFで「医療機器製造販売業の種類による、各責任者の兼務一覧表(17年1月24日付け)」 と言うのが昔はありましたが今は変わってしまったのでなくなりました。
*もし、他でこの資料を目にしたときは、上記の兼務一覧表は古いので参考として下さい。
医療機器製造販売業の兼務が拡大していますので、
医療機器製造販売業においての人的要件の兼務 というブログに書いています。
*この他に会社組織図としては、管理監督者、管理責任者 が必要になりますが、特に資格要件が必要としませんので、代表取締役で良いと思います。
医療機器製造販売業の各責任者の説明と資格要件(どんな方がなれるのか)の説明
業務システム要件(医療機器の品質マニュアル(品質管理監督システム基準書、QMS手順書)、医療機器GVP手順書
)
現在、医療機器製造販売業に関しては、GQPってのは無くなりました。
従来の製造販売業が行っていた品質管理(GQP)と製造業が行っていた品質管理(QMS)が合わせて、
医療機器製造販売業が行う品質管理システム(QMS) となっています。
品質管理監督システム と呼び、そのシステムを記載した文書を 品質マニュアル と呼びます。
*医療機器の品質管理の国際規格である、ISO13485に準じたシステムになりました。
医療機器の品質管理の主体が製造業者から、製造販売業者になったわけです。
医療機器製造販売業者は、販売する医療機器の品質管理を行わなければなりません。(業務としてです)
医療機器製造販売業者は、販売した医療機器の安全管理を行わなければなりません。(業務としてです)
(販売後の副作用など、医療施設、お客様からの問い合わせの情報収集や国などから出される安全情報の検討や対応です)
医療機器QMSになったことで、
従来の医療機器での人的組織要件では、総括製造販売責任者、品質保証責任者、安全管理責任者でしたが、
現在の医療機器QMSでは、このQMSを管理するために、管理監督者、管理責任者が上記の3名の上に必要になります。
(この管理監督者や管理責任者ってのはISOの考え方なのでISOと整合性を取らせるためです)
*ちなみに、ISO13485には医療機器GVPの部分が含まれていないので、従来通りに医療機器GVPは必要になります。
実際に運用する業務システムである、
医療機器の品質マニュアル(品質管理監督システム基準書、QMS手順書)
医療機器GVP手順書
を作成して、これに従い仕事していくわけです。
20.3 医療機器製造業の取り方(前準備)
医療機器製造業者には、法人でも個人(個人事業主)でもなることが出来ますので、ここでの申請者って書くのは両方指しています。
医療機器製造業の登録の申請者の要件
会社定款の目的に医療機器の製造 ってのが必要になります。
ざっくり書きますが、申請者の欠格事項ってのがいくつかあります。代表者や役員に、薬機法(旧薬事法)の許可取り消しや禁固以上の刑、薬事に関する違反の経歴、後見開始の審判 などが居る場合は申請することが出来ません。また、麻薬、大麻などの中毒者でないことも、医師の診断書で証明しなければなりません。*R3年8月から医師の診断書は原則不要になりました。
医療機器製造販売業の許可には、人的要件、構造設備要件、業務システム要件(システムって言ってもコンヒューターとかITとかではありません)が必要になります。
医療機器製造業の人的要件
責任技術者を常勤で配置する。
(医療機器製造販売業と同一の場所の場合、医療機器製造販売業の品責を兼務できます)
責任技術者の資格要件(どんな方がなれるのか)の説明
構造設備要件
ここでは、医療機器を輸入するために必要な医療機器製造業の構造設備になりますので、構造設備といっても、医療機器製造販売業の許可を取る事務所の一角で取れる話をします。
昔は化粧品製造業と同じように、(包装・表示・保管)区分ってのがありまして、その区分での許可でしたが、
現在は許可区分がなくなっています。
ここでは、構造設備に関しては包装表示保管しか業務を行わないことを前提にしています。
構造:事務所の一角をここですって感じで区分けテープで床を区切って下さい(パーテーションで仕切る必要はありません)ただし、衛生的に問題があるような場所を指定するのはダメでしょう(台所やトイレと隣接など)
(床材質はなんでもよいですが土ってのはないですね)
*これも都道府県の裁量なので、事前相談の必要あります。
設備:区分けテープで仕切った区域内に作業する机、製品を保管する棚、他にシュリンクする場合、ラベルを機械で貼る場合とかを置きますのでそれを用意してください。
業務システム要件(医療機器QMS)
ここでは、医療機器製造販売業の許可を取った事務所の一角で医療機器製造業を登録することを前提としていますので、
医療機器製造販売業の業務システム要件で書いたように、「製造業が行っていた品質管理(QMS)が合わせて、
医療機器製造販売業が行う品質管理システム(QMS) となっています。」
ですので、ここでは不要となります。
ただし、倉庫業者さんが、医療機器の包装・表示・保管業務を受託するために医療機器製造業の登録を行う場合には、
倉庫さん独自で品質マニュアルを作成しないと、製造販売業者から仕事を受けられないという事になりますので注意してください。
このページの書いてる事がわからない、うまくできない==>お問い合わせから、質問してください。